ریسکهای عفونی برای کاشتهای دهانی
چکیده مطلب
استفاده از ایمپلنتهای دهانی در باز توانی بیماران کاملا بیدندان و نیمه بیدندان به طور وسیعی ولو خرابیهایی رخ داده است، پذیرفته شده است. شانس ایمپلنت برای ادغام می تواند برای مثال به دلیل وجود داخل دهانی باکتریها و واکنش های التهابی مرتبط به مخاطره انداخته شود. طول عمر ایمپلنتهای ادغام استخوانی می تواند با بارگذاری بیش از حد انسدادی و/یا پری ایمپلنتیت تحریکی پلاک بسته به هندسه ایمپلنت و مشخصات سطحی آن بمخاطره انداخته شود. مطالعات جانوری، مشاهدات مقطعی و طولی در انسان و مطالعات ارتباطی نشان می دهد که پری ایمپلنتیت مشخصه اش یک میکروبیوتای قابل مقایسه با مال پریودونتیت (نسبت بالای میله ای های گرم منفی غیرهوازی، ارگانیسم های متحرک و اسپیروکت ها) می باشد. اما برای پیشگیری از چنین تغییر باکتریایی، سنجش های ذیل را می توان درنظر گرفت: سلامت پریودونتال در دندان نهاد باقیمانده (برای جلوگیری از جابجایی میکروبی)، اجتناب از جیب های پری ایمپلنت عمیق شده ، و استفاده از اتصال نسبتا نرم و سطح ایمپلنت نسبتا نرم. بالاخره عوامل تحریک کننده پریودونتیت مانند سیگار کشیدن و بهداشت بد دهان نیز ریسک پری ایمپلنتیت را افزایش می دهد. اینکه مستعدپذیری برای پریودونتیت مربوط به مال پری ایمپلنتیت است یا خیر ممکن است طبق نوع ایمپلنت و بویژه توپوگرافی سطحی آن متغیر باشد.
میزان موفقیت ایمپلنتها
میزان موفقیت بالینی بالای برخی طراحی های ایمپلنت در بیماران (نیمه) بی دندان همانگونه که توسط مطالعات آینده نگر درازمدت خوب طراحی شده نشان داده شده است، منجر به پذیرش و استفاده وسیع از ایمپلنت های دهانی گردیده است. در کنار یک تعداد فاکتورهای مرتبط با بیمار مانند مصرف سیگار، کیفیت استخوان، بیماریهای سیستماتیک یا شیمی درمانی، صدمه جراحی یا آلودگی باکتریایی طی جراحی ایمپلنت، فاکتورهای مرتبط با خرابی های اولیه (بهبود ناکامل، یعنی طی فاز بهبود و با این حساب قبل از بارگذاری) هم وجود دارند. بارگذاری بیش از حد (وضعیتی که در آن بار عملیاتی بکار بسته شده به ایمپلنت ها از ظرفیت سطح مشترک استخوان-ایمپلنت برای تحمل آن تجاوز می کند) علت مهم دیگر خرابی ایمپلنت اولیه زمانی که پروتز نصب شده است، می باشد. عوامل مرتبط با خرابی های تاخیری ایمپلنت به خوبی کمتری درک شده و به نظر می رسد که هم مرتبط به محیط پری ایمپلنت و هم پارامترهای میزبان باشد. زخمها مشابه با زخمهایی که مرتبط به دندان ها می باشند، مانند پری ایمپلینتیت، هیپرپلازی ژینژیوال، فیستول و از دست رفتن استخوان مرتبط به تجمع پلاک میکروبی می باشند. مقاله مروری حاضر متمرکز بر پری ایمپلنتیت و عوامل میکروبی مرتبط با شیوع آن است.
مطالعات اپیدمیولوژیک از اواخر دهه 80 میلادی نشان داده است که هیچ مستعدپذیری جهانی به پری ایمپلنتیت وجود نداشته است.
تنها 5 الی 20 درصد جمعیت از اشکال شدید پریودونیتیت رنج می برند. خرابی های ایمپلنت اخیر نیز به یک زیرمجموعه کوچک از افراد خوشه بندی می گردد. Wegant & Burt (1993) میزان بقای ایمپلنت دهانی را در یک گروه متشکل از 598 بیمار متوالی از اداره ثبت سربازان بازنشسته آمریکا بررسی نمودند. طی یک دوره 5/5 ساله، تعداد کل 81 ایمپلنت از 2098 تا در 45 تا از 598 بیمار خارج سازی گردید. احتمال خارج سازی یک ایمپلنت دوم تا 30 درصد در بیمارانی که بالواقع یک ایمپلنت را از دست داده بودند، افزایش یافت.
بهبود ناکامل / عفونت ایمپلنت اولیه
یک خرابی ایمپلنت اولیه یا بهبود ناکامل منطبق با عدم توانایی برقراری ادغام استخوانی است. مورد اخیر به صورت «اتصال ساختاری و عملیاتی مستقیم میان استخوان زنده مرتب شده و سطح یک ایمپلنت حامل بار» تعریف می شود. هر چند یک خرابی اولیه می تواند به دلیل فاکتورهای مختلفی صورت گیرد (مانند جراحی تروماتیک، حرارت دهی بیش از حد طی دریل کاری و غیره)، این مقاله تنها با نقش باکتری ها سروکار دارد. اما یک خرابی اولیه را نباید با پری ایمپلنتیت اشتباه گرفت، یعنی اصطلاحی که اشاره به «پروسه التهابی اثرگذار بر بافتهای اطراف یک ایمپلنت با ادغام استخوانی در عمل دارد که منجر به از دست رفتن استخوان حمایت کننده می گردد.
آلودگی قبل از عمل
منابع احتمالی آلودگی باکتریایی مستقیم طی جراحی (عفونت ایمپلنت یا سوکت استخوانی) عبارتند از
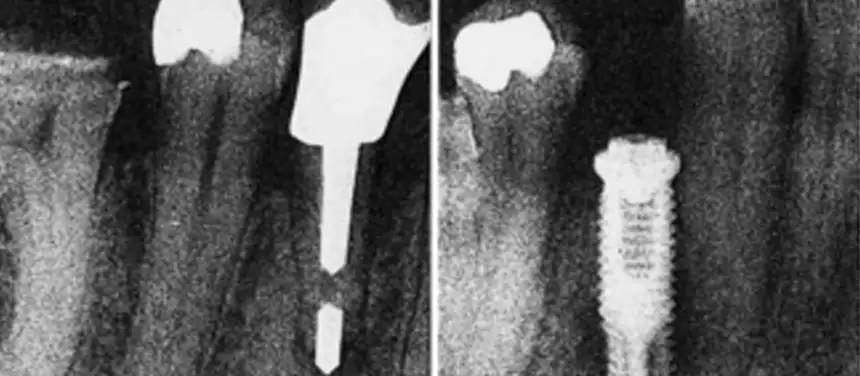
ابزار جراحی، دستکش، هوای اتاق عمل، هوای استنشاقی بیمار، بزاق حفره دهانی و پوست اطراف دهانی. چنین عفونتهایی می تواند منجر به آبسه دور یک ایمپلنت گردد (تصویر 1) که سرانجام با یک فیستول همراه می گردد. تصویر رادیوگرافی بعد از این نوع عفونت، که مشخصه اش رادیولوسنسی پری آپیکال دور ایمپلنت ها می باشد، نباید با اسکارهای ناشی از دریل کردن خیلی راسی یا از نکروز استخوانی آسپتیک در اثر حرارت اشتباه گرفته شود.
برای پیشگیری از آلودگی حاصل از حفره دهانی، چندین ادیده مطرح گردیده است. کاهش جریان بزاقی توسط آتروپین، وضعیت طاقباز بیمار و حفاظت از صفحه جراحی توسط دریچه صیادی دهانی می تواند از آلودگی زخم دست کم در بخش فوقانی حفره دهانی اجتناب کند و تنها در صورتی که دو آسپیراسیون جراحی مجزا استفاده گردد (یکی برای زخم و یکی برای حفره دهانی). وانگهی، بار میکروبی بزاقی می تواند تا 95 درصد از طریق آبکشی قبل از عمل جراحی با کلروهگزیدین کاهش یابد. ضدعفونی پوست اطراف دهانی با یک محلول کلروهگزیدین-الکل تنها می تواند تا اندازه ای بار میکروبی را روی این سطح کاهش دهد. در رابطه با پوست و موکوس سوراخ بینی، یک کلاهک سوراخ دار باید روی دماغ بیمار نصب گردد. زمانی که کلیه پیش احتیاطهای فوق انجام گردید، تجویز آنتی بیوتیک های پروفیلاکتیک قبل از قرارگیری ایمپلنت دیگر لازم نیست. این امر با مشاهده خودمان به اثبات رسیده که وقوع ایمپلنت های غیرادغامی (حدود 2%) یا عفونت های موضعی زمانی که تجویز روتین آنتی بیوتیک جایگزین یک تجویز گاه به گاه گردیده (برای مثال زمانی که آلودگی زخم با بزاق به دلیل جابه جایی فک بدون کنترل یا سرفه رخ می داد) افزایش نیافتند.
در یک مطالعه چندمرکزی آینده نگر روی استفاده از ایمپلنت های دهانی ادغام استخوانی در بیماران نیمه بی دندان چند خرابی اولیه در افراد با indice های بالای پلاک و ژینژیویت متمرکز گردیده بود. چنین فرضیه داده شده است که یا آلودگی قبل از عمل جراحی و/یا عفونت های هوازی با پروسه ادغام استخوانی تداخل می کند یا اینکه ژینژیویت همزمان مسئول بود. برخی از افراد هنوز بر این باورند که کنترل عفونت طی جراحی پریودنتال غیرممکن است چون در یک محیط آلوده انجام شده است. این امر اشتباه میان آلودگی را با همزیست های پاتوژنیک نهایی و باکتری های خارجی (برای مثال از سایر بخش های بدن) یا اگزوژن را نشان می دهد. از اینرو، حتی مداخلات پروکتولوژیک ژیناکولوژیک در سنجش های دقیق استریلیته دخیل است.
محل گیرنده عفونی شده
عفونتها/پروسه های التهابی درون استخوان فک در مجاورت نزدیک یک ایمپلنت ادغامی مانند زخم های پری آپیکال دور دندانهای مجاور، کیست ها و/یا بقایا یا اجسام خارجی (برای مثال ماده اندودندریتیک) می توان با ادغام استخوانی تداخل داشته باشد. Shaffer و همکارانش یک مجموعه گزارش موردی چاپ کردند که در آن نصب یک ایمپلنت نزدیک به یک دندان با اندودونتیک پاتوز (پایدار یا درمان شده) منجر به یک گسترش برجسته زخم پری اپیکال می گردد (تصویر 1). اینکه آیا گسترش مستقیم اندوتوکسین باکتریایی یا سلولهای التهابی، یا خود باکتریها مسئول آلوده سازی ایمپلنت می باشند یا خیر نامعلوم است. یک بررسی کامل رادیوگراف قبل از ورود ایمپلنت همراه با ارزیابی زیست پذیری دندانهای مجاور توصیه می شود. فرد باید بویژه درک کن که یافته های رادیوگرافیکی همیشه بازتاب اندازه واقعی یک پروسه التهابی نیست (یک آبسه پری اپیکال، گرانولوما یا کیست). در واقع، نواقص مدولار ایجاد شده مکانیکی در فک پایین جسد برای مثال نمی تواند بر مبنای شواهدی از رادیوگراف های متداول صورت گیرد مگر اینکه این نواقص به استخوان برون لایه ای رسیده باشد. در یک گزارش اخیر، Farman و همکارانش صحت یک هیئت از متخصصان دندان ریشه شناسی و متخصصان تشخیص بیماریهای دهانی را در برآورد اندازه رادیولوسنسی پری آپیکال روی تصاویر آنالوگ یا دیجیتال (دومی با و بدون تقویت کنندگی) مقایسه نمودند. هر چند برآوردهای بهتری با تصاویر دیجیتال /تقویت شده بدست آمد، تخمین های کمتر از حد هنوز از 0.5 تا 2mm (اندازه گیری مزیو-دیستال) و از 2.5 تا 4 mm (اندازه گیری های فوقانی –جلویی) دامنه داشت. نهایتا، ارزیابی رادیوگرافی زخمهای پری آپیکال نیز بخاطر تنوعات زیادی در توانایی های تشخیصی در میان شاهدان مورد مخاطره قرار گرفت. زخمهای پری آپیکال حتی روی توموگرام ها نادیده می ماند.
عفونت های اولیه
علائم عفونت ها (تورم، فیستولها و درد) طی دوره بهبودی یک ایمپلنت دومرحله ای که هنوز نیمه فرورفته است نیز می تواند به بافتهای نرم محدود گردد. عللی که مرتب گزارش شده اند یک بخیه باقیمانده، یک سرپوش پیچ با نصب ضعیف، یا صدمه در اثر دنچر با آسودگی نامناسب، یک ایمپلنت protruding یا ضربه در اثر دندانهای آنتاگونیستی است.
شکل 1 .
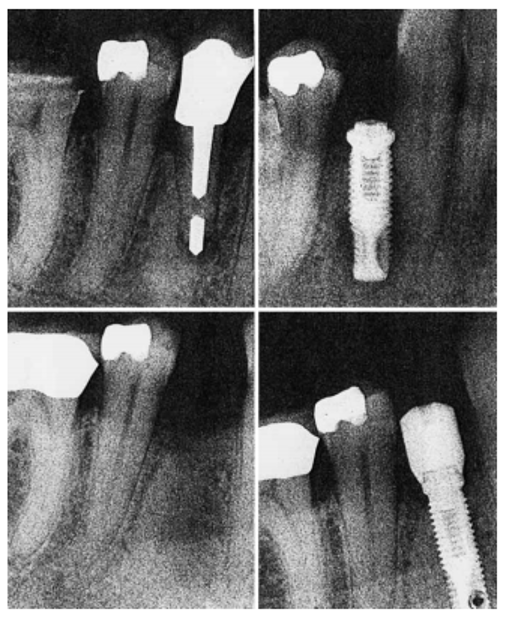 |
پری ایمپلنتیت
رابطه سببی میان تجمع پلاک باکتریایی و ژینژیویت یا پریودونتیت به خوبی محقق گشته است. برخی باکتری ها در مقادیر بسیار بزرگتری از جایگاههای پریودونتال بیمار نسبت به جایگاههای سالم جداسازی شده اند و پریودونتوپاتیک نامیده شده اند.
مطالعات جانوری روی موکوزیت های پری ایمپلنت و پری ایمپلنتیت
پاسخ بافتی به ساخت میکروبی اطراف دندانها و ایمپلنت های دهانی در چندین آزمایش جانوری مورد تحقیق قرار گرفته است.
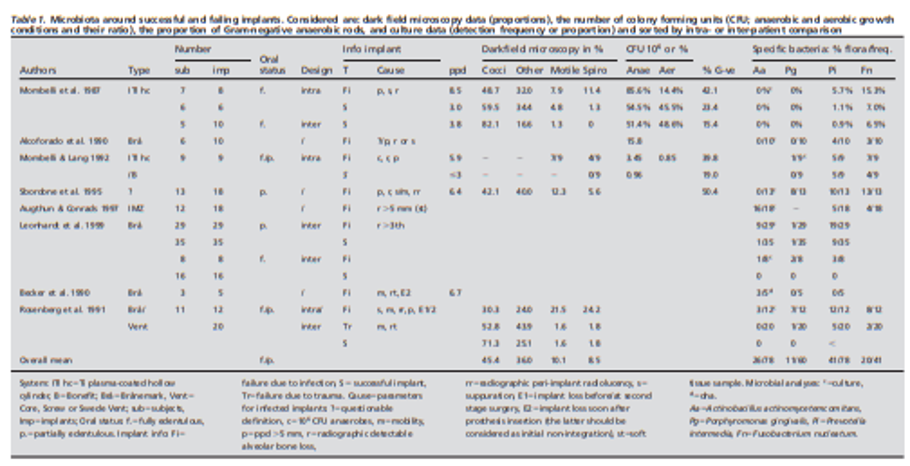
جدول 1 .
 |